Moleküle können aktive Cluster bilden, die Stoffwechselprozesse katalysieren, indem sie selbsterzeugten Konzentrationsgradienten folgen - dies ist das Ergebnis einer neuen Studie von Wissenschaftlern des Max-Planck-Instituts für Dynamik und Selbstorganisation (MPI-DS). Ihr Modell beschreibt die Selbstorganisation von Molekülen, die an Stoffwechselwegen beteiligt sind, und fügt so der Theorie über den Ursprung des Lebens einen möglichen neuen Mechanismus hinzu. So lässt sich besser verstehen, wie an komplexen biologischen Netzwerken beteiligte Moleküle, dynamische und funktionale Strukturen bilden können. Darüber hinaus bieten die Ergebnisse einen Ansatzpunkt für weitere Experimente zur Entstehung des Lebens.
Ein mögliches Szenario für den Ursprung des Lebens ist die spontane Organisation von interagierenden Molekülen zu zellartigen Tröpfchen. Diese bilden in der Folge die ersten selbstreplizierenden Stoffwechselzyklen, welche in der Biologie weit verbreitet und in allen Organismen zu finden sind. Diesem Szenario nach müssten sich die ersten Biomoleküle dabei durch langsame, allerdings überwiegend ineffiziente Prozesse zusammenschließen. Eine solch langsame Clusterbildung scheint unvereinbar mit der Geschwindigkeit, mit der das Leben entstanden ist. Wissenschaftler der Abteilung Physik der lebenden Materie des MPI-DS haben nun ein alternatives Modell vorgeschlagen, das eine solche Clusterbildung von katalytisch aktiven Molekülen und damit das schnelle Einsetzen der für die Entstehung von Leben erforderlichen chemischen Reaktionen erklärt.
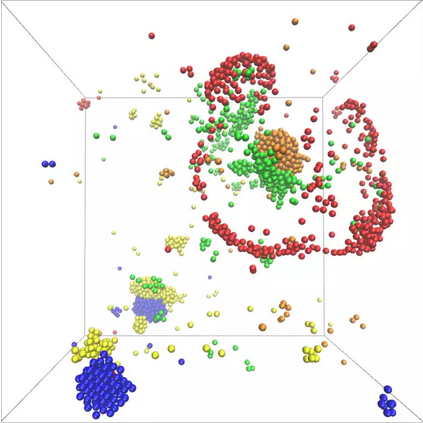
"Dazu haben wir verschiedene Moleküle in einem einfachen Stoffwechselzyklus betrachtet, bei dem jedes Molekül oder Partikel eine Chemikalie produziert, die von dem nächsten verwendet wird", berichtet Vincent Ouazan-Reboul, Erstautor der Studie. "Die einzigen Bestandteile des Modells sind dabei die katalytische Aktivität der Moleküle, ihre Fähigkeit einem selbsterzeugten Konzentrationsgradienten der Chemikalien zu folgen, sowie die Information über die Reihenfolge der Moleküle im Zyklus", fährt er fort. Unter diesen Voraussetzungen zeigt das Modell die Bildung von katalytischen Clustern, die verschiedene Molekülarten enthalten. Das Wachstum von Clustern erfolgt zudem exponentiell: Die Moleküle können sich also sehr schnell und in großer Zahl zu dynamischen Strukturen zusammensetzen.
Darüber hinaus spielt die Anzahl der Molekülspezies, die am Stoffwechselzyklus teilnehmen, eine Schlüsselrolle für die Struktur der gebildeten Cluster. Ramin Golestanian, Direktor am MPI-DS, fasst zusammen: "Unser Modell führt zu einer Fülle komplexer Szenarien für die Selbstorganisation und macht spezifische Vorhersagen über funktionelle Vorteile, die sich bei einer ungeraden oder geraden Anzahl von beteiligten Spezies ergeben. Bemerkenswert ist, dass die nicht-reziproken Interaktionen als notwendiger Bestandteil in unserem vorgeschlagenen Szenario in allen Stoffwechselzyklen zu beobachten sind."
In einer anderen Studie fanden die Autoren heraus, dass Selbstanziehung von Molekülen für die Clusterbildung in einem kleinen Stoffwechselnetzwerk nicht erforderlich ist. Stattdessen können Netzwerkeffekte dazu führen, dass sich sogar eigentlich abstoßende Molekülspezies zu Gruppen zusammenschließen. Damit zeigen die Forscher neue Bedingungen auf, unter denen komplexe Wechselwirkungen selbstorganisierte Strukturen schaffen können.
Insgesamt fügen die neuen Erkenntnisse der Studien der Theorie zur Entstehung des Lebens aus einfachen Molekülen einen weiteren Mechanismus hinzu. Sie decken auf, wie an Stoffwechselnetzwerken beteiligte Moleküle selbstständig komplexe Strukturen bilden können.
Kontakt
Manuel Maidorn
Press officer
+49 551 5176 668
manuel.maidorn@...
Originalveröffentlichung
1. Ouazan-Reboul, V., Agudo-Canalejo, J. & Golestanian, R.
Self-organization of primitive metabolic cycles due to non-reciprocal interactions.
Nat Commun 14, 4496 (2023)
Source | DOI
2. Ouazan-Reboul, V., Golestanian, R. & Agudo-Canalejo, J.
Network effects lead to self-organization in metabolic cycles of self-repelling catalysts
arXiv:2304.09925
Source | DOI