Wie das kooperative und kollektive Verhalten zwischen Zellen während der Zelladhäsion unter der Wirkung externer, mechanischer Kräfte entsteht, erklären Kristian Blom und Aljaž Godec in ihrer neuesten Publikation. Die Wissenschaftler am Göttinger Max-Planck-Institut für biophysikalische Chemie liefern damit einen mathematischen Beweis für die Existenz eines neuartigen dynamischen Phasenübergangs. Außerdem diskutieren sie, warum dieses Zellverhalten für den Gewebeumbau, Krebsmetastasen und Immunreaktionen relevant ist. (Physical Review X, 27. September 2021)
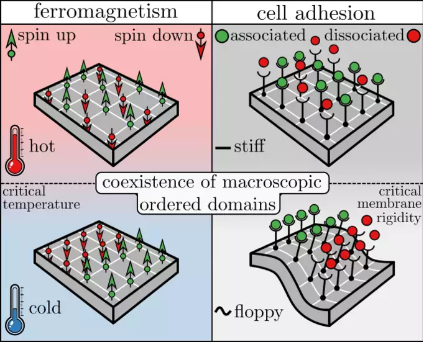
Wenn sich Zellen aneinander oder an eine extrazelluläre Matrix binden („kleben“), spricht man von „Zelladhäsion“. Dieses Phänomen ist von enormer Bedeutung für diverse biologische Prozesse. Ursprünglich wurde angenommen, dass die Biochemie der Adhäsionsbindungen bestimmt, wie stark sich die Zellen binden. Tatsächlich scheint es aber die Mechanik, insbesondere die Steifigkeit der zellulären Membran zu sein, die die Bindungskraft entscheidend beeinflusst, wenn nicht sogar dominiert. Auch wie Wechselwirkungen zwischen benachbarten Adhäsionsbindungen durch thermische Schwankungen der zellulären Membran zustande kommen, ist mittlerweile gut erforscht. Im Gegensatz dazu bleibt weiter unklar, inwieweit diese Wechselwirkungen die Stärke und Kinetik der Adhäsion regulieren. Weiter ist nicht bekannt, ob die Wechselwirkungen beeinflussen, wie die Bindungen auf die mechanischen Kräfte reagieren, die in physiologischen und pathologischen Prozessen auftreten.
Das haben Blom und Godec nun untersucht. Für ihre Studie haben die Göttinger Forscher den Adhäsionsprozess auf einem zweidimensionalen, dynamischen Spin-Modell mit folgenden Einflussfaktoren abgebildet: wechselwirkende Adhäsionsbindungen mit einer intrinsischen Affinität und unter Einwirken einer externen Kraft, die zu jedem Zeitpunkt auf alle assoziierten Adhäsionsbindungen gleichmäßig verteilt wird. Die Wissenschaftler liefern einen mathematischen Beweis für die Existenz eines neuartigen dynamischen Phasenübergangs, bei dem Adhäsionsdomänen am schnellsten entstehen (beziehungsweise sich auflösen) und sich die kollektive Vielteilchendynamik qualitativ verändert. Variationen in der Steifigkeit der zellulären Membran und von externen Kräften beeinflussen die Adhäsionsbindungen am stärksten in der Nähe des entsprechenden dynamischen „kritischen Punktes“.
Die Arbeit bietet neue Einblicke in die statistische Physik von Vielteilchensystemen und schlägt eine Brücke von abstrakter Physik zu zellulärer und molekularer Biologie. In Zukunft wollen Blom und Godec ein noch detaillierteres theoretisches Modell der Zelladhäsion erstellen, das Bindungen einbezieht, die sich unter Kraft verstärken – so genannte „catch-bonds“. Damit möchten sie ein tieferes Verständnis der Zelladhäsion unter Krafteinwirkung erreichen.
Kontakt
Dr. Aljaž Godec
Emmy Noether Research Group Mathematical Biophysics
+49 551 201-2304
agodec@...
Originalveröffentlichung
Blom K & Godec A
Criticality in Cell Adhesion
Phys Rev X (2021)
Source