Antibiotika zählen zu den wichtigsten Errungenschaften der modernen Medizin und haben seit der Entdeckung des Penicillins vor fast 100 Jahren Millionen Menschenleben gerettet. Viele durch bakterielle Infektionen hervorgerufene Krankheiten werden mit Antibiotika erfolgreich und effizient behandelt, ob Lungenentzündung, Hirnhautentzündung oder sexuell übertragbare Krankheiten. Allerdings können Bakterien gegen die eingesetzten Antibiotika Resistenzen entwickeln, die Antibiotika wirken dann nicht mehr.
Besonders problematisch sind die sogenannten multiresistenten Erreger, denen die meisten gängigen Antibiotika nichts anhaben können. Dies führt bei betroffenen Patienten zu schweren Krankheitsverläufen mit oft tödlichem Ausgang. Die Suche nach neuartigen Antibiotikaklassen ist daher von großer Wichtigkeit und Wissenschaftler weltweit arbeiten daran. Forscherinnen und Forscher der Universität Göttingen und des Max-Planck-Instituts (MPI) für biophysikalische Chemie Göttingen haben jetzt einen neuen vielversprechenden Ansatz präsentiert, um neue Antibiotikaklassen zu entwickeln.
Giftiges Antivitamin tötet Bakterien ab
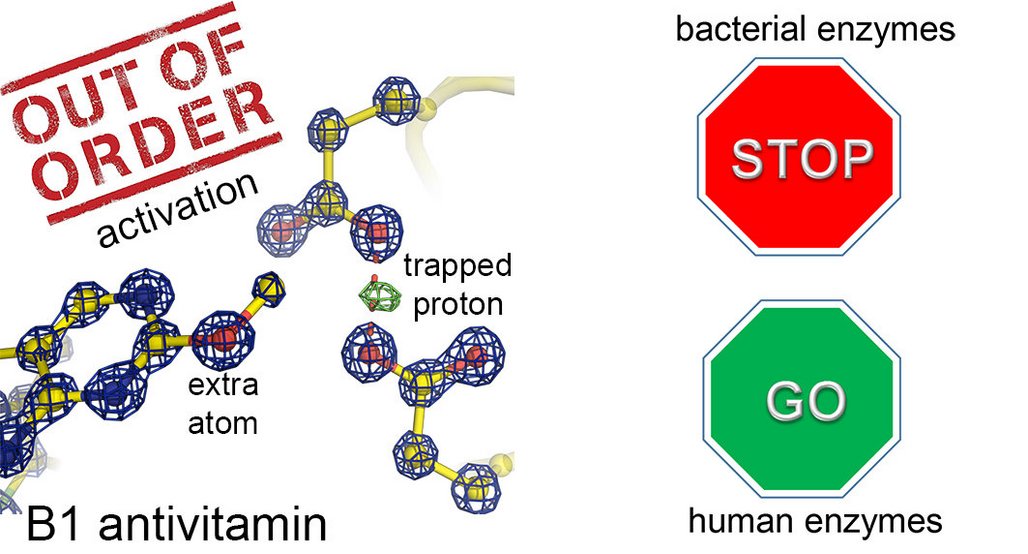
Für die Studie kooperierte das Team um Kai Tittmann vom Göttinger Zentrum für Molekulare Biowissenschaften an der Universität Göttingen mit der Gruppe von Max-Planck-Forscher Bert de Groot und Tadgh Begley von der Texas A&M University (USA). Gemeinsam untersuchten sie den atomaren Wirkmechanismus eines natürlich vorkommenden Antivitamins des Vitamins B1. Einige Bakterien sind in der Lage, eine toxische Form dieses lebenswichtigen Vitamins herzustellen, um konkurrierende Bakterien abzutöten. Das Antivitamin hat nur ein einziges Atom zusätzlich zum natürlichen Vitamin an einer scheinbar unwichtigen Stelle im Molekül und die spannende Frage war, warum das Vitamin trotzdem „vergiftet“ ist.
Das Team um Tittmann untersuchte mittels hochaufgelöster Proteinkristallografie, wie das Antivitamin ein wichtiges Protein aus dem Stoffwechsel von Bakterien hemmt. Dabei zeigte es sich, dass der „Tanz der Protonen“, den man normalerweise in funktionierenden Proteinen beobachten kann, fast vollständig zum Erliegen kommt, das Protein arbeitet nicht mehr. „Dieses eine zusätzliche Atom des Antivitamins ist wie das berühmte Sandkorn in einem komplexen Getriebe, das die fein abgestimmte Mechanik blockiert“, erklärt der Strukturbiologe. Interessanterweise kommen menschliche Proteine mit dem Antivitamin vergleichsweise gut klar und arbeiten weiter. Warum das so ist, untersuchten der Chemiker Groot und seine Gruppe mittels Computersimulationen. „Die menschlichen Proteine binden das Antivitamin entweder gar nicht oder so, dass sie nicht ‚vergiftet‘ werden“, so der Max-Planck-Forscher. Die unterschiedliche Wirkung des Antivitamins auf bakterielle und humane Proteine eröffnet die Möglichkeit, neue therapeutische Alternativen zu herkömmlichen Antibiotika zu entwickeln.
Kontakt
Prof. Dr. Kai Tittmann
Molecular Enzymology Group,
University of Göttingen
+49 551 39-177811
ktittma@...
Prof. Dr. Bert L. de Groot
Computational Biomolecular Dynamics Research Group,
Max Planck Institut for Biophysical Chemistry
+49 551 201-2308
bgroot@...
Dr. Carmen Rotte
Press Officer and Head of Public Relations,
Max Planck Institute for Biophysical Chemistry
+49 551 201-1304
Carmen.Rotte@...
Originalveröffentlichung
Fabian Rabe von Pappenheim, Matteo Aldeghi, Brateen Shome, Tadhg Begley, Bert L. de Groot & Kai Tittmann
Structural basis for antibiotic action of the B1 antivitamin 2′-methoxy-thiamine.
Nature Chemical Biology, August 24, 2020.
DOI