Ein neues Kernspinresonanz-Verfahren ermöglicht, spezifische Bereiche von Molekülen zu untersuchen, und kann Hintergrundsignale während der Messung unterdrücken. Die von Stefan Glöggler und seinem Team am Max-Planck-Institut (MPI) für biophysikalische Chemie entwickelte Methode soll zukünftig auch für die medizinische Diagnostik mittels Magnetspinresonanz-Tomografie (MRT) nutzbar sein.
Die Kernspinresonanz (kurz NMR) hat unsere heutige Welt massiv beeinflusst. Auf ihr basiert die MRT, mit der Kliniken und Praxen weltweit Millionen von Kernspin-Bildern jährlich aufnehmen, um Krankheiten zu erkennen und zu erforschen oder Therapieverläufe zu beobachten. Die NMR ist zudem eine der Standardmethoden, um Proteine und andere Moleküle in atomarer Auflösung zu untersuchen: Welche dreidimensionale Form haben Proteine in der Zelle und wie verrichten sie ihre Aufgabe? Wie wechselwirken sie miteinander oder mit einem Wirkstoff?
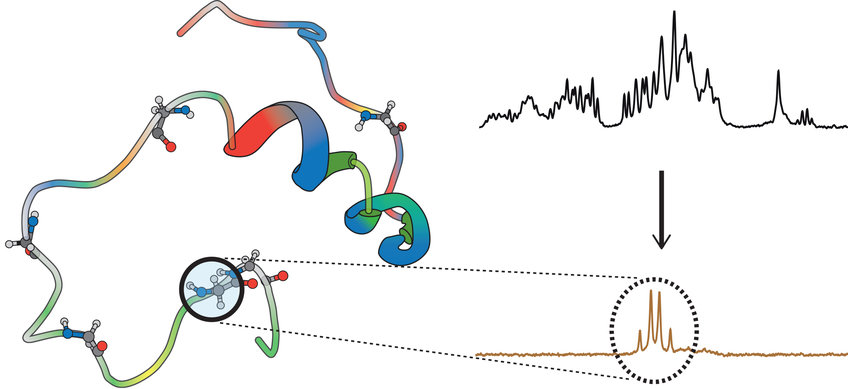
Die NMR macht sich zunutze, dass viele Atomkerne magnetische Eigenschaften besitzen, den sogenannten Kernspin. Dieser verhält sich wie ein kleiner Stabmagnet: Wird der Atomkern einem Magnetfeld ausgesetzt, orientiert sich der Spin entlang dieses Feldes. Mittels eingestrahlter Radiowellen werden die Spins gedreht und kehren mit dem Ausschalten der Radiowellen wieder in ihren Ausgangszustand zurück. Dabei senden die Spins elektromagnetische Signale aus, die stark von ihrer Umgebung abhängen. Indem Wissenschaftler diese Signale detektieren, erhalten sie wichtige Informationen über die Struktur und Dynamik von Molekülen.
Hintergrundsignale reduzieren
Ein Problem dabei: Forscher empfangen nicht nur Signale der gewünschten Molekülstruktur oder chemischen Gruppe, sondern auch eine Menge Hintergrundsignale von anderen Proteinen in der Umgebung oder dem allumgebenden Wasser. Hier setzt das neue Verfahren von Glöggler an, das in der aktuellen Ausgabe des Fachmagazins Science Advances mit Salvatore Mamone als Erstautor veröffentlicht wird. „Es erlaubt uns, die Signale einzelner Protein-Bausteine oder Stoffwechselprodukte gezielt an- oder auszuschalten“, berichtet Glöggler.
Damit dies funktioniert, verwendet Glögglers Team einen ausgeklügelten Trick: „Für unseren Schalter nutzen wir aus, dass viele Moleküle mehrere Wasserstoffatome enthalten. Diese verhalten sich wie Kompassnadeln, die immer nach Norden zeigen – der typische Zustand, der über Kernspin detektiert wird“, erklärt der Forschungsgruppenleiter, „Und jeweils zwei Wasserstoffatome koppeln über chemische Bindungen miteinander. Wenn wir dann eine dieser Kompassnadeln so verdrehen, dass sie nach Süden zeigt, während die andere nach Norden ausgerichtet bleibt, schaffen wir einen für den Kernspindetektor unsichtbaren, geschützten Zustand“, so der Chemiker weiter. Diesen geschützten Zustand erzeugen die Forscher in beliebig koppelnden Spins genau in dem Bereich des Moleküls, den sie untersuchen wollen. Im nächsten Schritt werden alle anderen, ungeschützten Hintergrundsignale unterdrückt. Nun müssen die geschützten Spins nur noch wieder in den Normalzustand zurückversetzt werden und die Wissenschaftler können die gewünschten Signale dann detektieren – ganz ohne Überlagerung.
Sehr langsame dynamische Prozesse untersuchen
Der geschützte Zustand hat einen weiteren großen Vorteil: Der nach Süden zeigende Spin schwenkt von allein nur langsam wieder Richtung Norden. Mit der neuen Methode lassen sich daher sehr langsam verlaufende, dynamische Prozesse besser untersuchen als mit herkömmlichen Kernspinverfahren.
Die Technik will Glöggler zukünftig auch einsetzen, um krankheitsbedingte Protein-Verklumpungen besser zu verstehen. Solche Ablagerungen sind unter anderem im Gehirn von Patienten zu finden, die an neurodegenerativen Erkrankungen wie Alzheimer und Parkinson leiden. Darüber hinaus lässt sich mit dem neuen NMR-Verfahren aufklären, wie Wirkstoffe mit Zielmolekülen wechselwirken. Auch die Anwendung der neuen Methode für Patienten hat der Göttinger Wissenschaftler im Blick und möchte diese für die MRT direkt nutzbar machen. „Insbesondere wollen wir Stoffwechselprodukte direkt im Gewebe analysieren, um die Veränderungen des Stoffwechsels bei Erkrankungen genauer zu untersuchen. Wir hoffen, dass solche Erkenntnisse auch in der medizinischen Diagnostik verwendet werden können“, sagt der Max-Planck-Forscher.
Kontakt
Dr. Stefan Glöggler
Max-Planck-Forschungsgruppenleiter
+49 551 201-2215
stefan.gloeggler@...
Dr. Carmen Rotte
Pressesprecherin, Presse- und Öffentlichkeitsarbeit
+49 551 201-1304
carmen.rotte@...
Original-Publikation
Salvatore Mamone, Nasrollah Rezaei-Ghaleh, Feiipe Opazo, Christian Griesinger, Stefan Glöggler.
Singlet-filtered NMR spectroscopy
Science Advances 6, eaaz1955
Source
DOI