Forscher des Max-Planck-Instituts (MPI) für biophysikalische Chemie und des Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE) haben die Feinstruktur verklumpter Alpha-Synuklein-Proteine erstmals anhand von Gewebeproben aus Patienten analysiert. Bisher hatte man vor allem künstlich aggregierte Proteine untersucht. Die Ergebnisse zeigen, dass sich die Protein-Strukturen der klinischen Proben von den künstlichen unterscheiden und bei Parkinsonpatienten überraschend vielfältig sind. Dies zeigt, wie wichtig ergänzende Studien mit Gewebeproben sind.
Arme und Beine beginnen zu zittern, die Muskeln werden steif: Parkinson und Multisystematrophie (MSA) sind neurodegenerative Erkrankungen und können mit diversen Beeinträchtigungen einhergehen. Sie unterscheiden sich zwar in ihren Symptomen und betreffen auch unterschiedliche Teile des Nervensystems. Gemeinsam ist aber beiden, dass sogenannte Alpha-Synuklein-Proteine in den Nervenzellen des Gehirns verklumpen und sich in diversen Hirnregionen ablagern. „Diese Ablagerungen sind ein typisches Krankheitsmerkmal“, erläutert Markus Zweckstetter, Forschungsgruppenleiter am DZNE und am MPI für biophysikalische Chemie.
Das „normale“ Protein Alpha-Synuklein spielt eine wichtige Rolle bei der Kommunikation von Nervenzellen. Neben dieser Variante gibt es jedoch noch weitere, die mit Hirnerkrankungen wie Parkinson und MSA verknüpft sind.
Eine Frage der Form
Die typischen, faserigen Ablagerungen von Alpha-Synuklein sind ein möglicher Ansatzpunkt für Medikamente. Die Wirkstoffe könnten das Verklumpen unterbinden oder schon bestehende Verklumpungen auflösen, so die Idee. Um mögliche Andockstellen dafür zu identifizieren, sind Daten über die Feinstruktur dieser Protein-Ansammlungen allerdings unerlässlich. Die Frage ist also: Welche Form nehmen die Alpha-Synuklein-Moleküle innerhalb der Ablagerungen an?
„Wir haben uns die Frage gestellt, wie gut die im Reagenzglas hergestellten Alpha-Synuklein-Aggregate die Situation beim Patienten widerspiegeln. Deshalb haben wir uns Proben angeschaut, die aus Gewebe von Patienten hergestellt wurden“, so Zweckstetter. „Dabei haben wir eng mit internationalen Partnern zusammengearbeitet. Die Gewebeproben stammen aus Australien, die Aggregate daraus wurden in Südkorea generiert. Die Struktur-Untersuchungen haben wir am MPI für biophysikalische Chemie und am DZNE in Göttingen durchgeführt.“
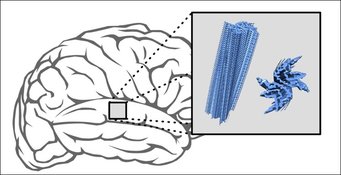
Die Wissenschaftler untersuchten Ablagerungen aus Gehirnproben von je fünf verstorbenen Parkinson- und MSA-Patienten. Zum Vergleich stellten sie verschiedene Varianten von verklumpten Alpha-Synuklein-Aggregaten künstlich her. Mittels NMR-Spektroskopie und weiterer Methoden verglichen die Forscher dann die Struktur der verschiedenen Aggregate.
Vielfältige Ablagerungsformen bei Parkinson
„Wir haben festgestellt, dass die verklumpten Proteine aus dem Labor eine andere Struktur hatten als alle aus Patientenmaterial hergestellten Ablagerungen“, kommentiert Timo Strohäker, Erstautor der Studie, die Befunde. „Zudem unterschieden sich die Proteine der MSA-Patienten von jenen der Parkinson-Patienten. Die Proteine der verschiedenen MSA-Patienten hatten alle eine weitgehend ähnliche Form. Die Proteine der Parkinson-Patienten waren deutlich uneinheitlicher.“
Die unterschiedlichen Alpha-Synuklein-Ablagerungen bei Parkinson-Patienten könnten eine Erklärung sein, warum der Verlauf der Parkinson-Erkrankung von Mensch zu Mensch recht unterschiedlich sein kann. „Dies würde der Hypothese widersprechen, dass Parkinson nur mit einer einzigen, klar definierten Form von Proteinablagerungen einhergeht. Angesichts unserer relativ kleinen Stichprobe von fünf Patienten lässt sich das aber nur vermuten“, so Zweckstetter.
Kontakt
Prof. Dr. Markus Zweckstetter
Forschungsgruppe Proteinstrukturbestimmung mittels NMR, Gruppenleiter am Deutschen Zentrum für Neurodegenerative Erkrankungen
+49 551 201-2220
mzwecks@...
Carmen Rotte
Presse- und Öffentlichkeitsarbeit
+49 55 1201-1304
carmen.rotte@...
Originalpublikation
Timo Strohäker, Byung Chul Jung, Shu-Hao Liou, Claudio O. Fernandez, Dietmar Riedel, Stefan Becker, Glenda M. Halliday, Marina Bennati, Woojin S. Kim, Seung-Jae Lee & Markus Zweckstetter
Structural heterogeneity of α-synuclein fibrils amplified from patient brain extracts
Nature Communications (2019)
DOI