Weil bestimmte Anteile der Zelle, die eine Übersetzung der Erbsubstanz enthalten, vom Zellkern in einen anderen Teil der Zelle wandern, werden sie vom Zugriff von Zellmaschinen, den sogenannten Spleißosomen, geschützt. Geschieht dies nicht, ist die gesamte Zelle in Gefahr und es können Krebs und neurodegenerative Krankheiten entstehen. Forscherinnen und Forscher der Universität Göttingen und der Universitätsmedizin Göttingen haben den zugrundeliegenden Mechanismus in der Zelle aufgezeigt. Die Ergebnisse sind in der Fachzeitschrift Cell Reports erschienen.
Menschliche Zellen unterteilen sich in einen Zellkern, der die Erbsubstanz in Form von DNA enthält, und das Zellplasma, in dem Proteine hergestellt werden. Im Zellkern wird die DNA, die den Bauplan für den Organismus enthält, in eine andere Form, die Boten-RNA, umgeschrieben, um sie etwa zu transportieren und eine Abschrift des Bauplans zur Proteinherstellung verwenden zu können. Getrennt vom „Original“, also der DNA, werden die Proteine dann im Zellplasma produziert. Die Trennung ist deshalb wichtig, weil die Boten-RNA nicht sofort fertig vorliegt. Vielmehr wird erst ein Vorläufer hergestellt, welcher noch Bereiche enthält, die entfernt werden müssen, bevor die Boten-RNA das Zellplasma erreicht. Werden diese nicht vorher entfernt, entstehen zum Beispiel verkürzte oder gar keine funktionellen Proteine, was gefährlich für die Zelle ist.
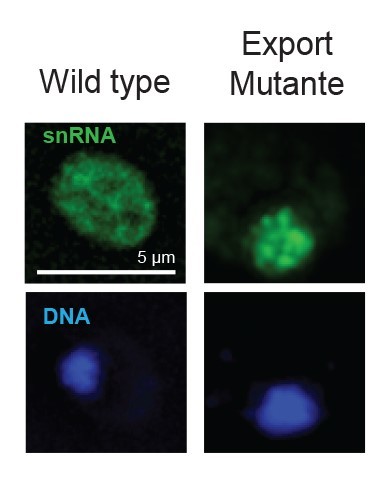
Die „Maschinen“, die diese Bereiche aus der Boten-RNA herausschneiden, sind die Spleißosomen – sie enthalten Proteine und einige „Abschriften“ der DNA, die snRNA, die nicht wie die Boten-RNA in Proteine übersetzt werden, sondern zusammen mit den Proteinen die Maschine, nämlich das Spleißosom bilden. In menschlichen Zellen bewegt sich die snRNA der Spleißosomen ebenfalls ins Zellplasma. In anderen Organismen wie etwa der Bäckerhefe, die häufig als Modellorganismus in der Forschung verwendet wird, nahmen Wissenschaftler bislang an, dass die snRNA der Spleißosomen den Zellkern niemals verlassen. Bislang war auch unklar, was der Grund für die evolutionäre Entwicklung zum Export der Boten-RNA in Spleißosomen menschlicher Zellen gewesen sein könnte.
„Unsere Experimente zeigen, dass die snRNA der Spleißosomen auch in der Hefe in das Zellplasma wandern“, sagt Prof. Dr. Heike Krebber, Leiterin der Abteilung Molekulare Genetik am Institut für Mikrobiologie und Genetik der Universität Göttingen. In einem zweiten Schritt klärten die Forscherinnen und Forscher die Frage, warum sich die Boten-RNA der Spleißosomen überhaupt in das Zellplasma bewegt, wo doch die Aufgabe der Spleißosomen ist, einzelne RNA-Bereiche herauszuschneiden – was im Zellkern stattfindet. Das Forscherteam manipulierte die Hefe durch genetische Experimente, sodass die Vorläufer der snRNA nicht mehr ins Zellplasma wechselt. Die Beobachtung: „Die Spleißosomen versuchen, auch mit den Vorläufern, der unfertigen snRNA, zu arbeiten, was nicht funktioniert“, so Krebber. „Aus diesem Grund müssen gesunde Zellen die Vorläufer der Boten-RNA sofort nach ihrer Herstellung erst mal aus dem Zellkern herausschicken, um sie dem Zugriff der sich formierenden Spleißosomen zu entziehen.“ Dieses grundlegende Verständnis ist wichtig, um der Entstehung von Krankheiten auf den Grund zu gehen.
Originalveröffentlichung:Becker et al. Nuclear Pre-snRNA Export is an Essential Quality Assurance Mechanism for Functional Spliceosomes. Cell Reports (2019). https://doi.org/10.1016/j.celrep.2019.05.031
Kontakt:
Prof. Dr. Heike Krebber
Georg-August-Universität Göttingen
Abteilung Molekulare Genetik
Institut für Mikrobiologie und Genetik
Grisebachstr. 8, 37077 Göttingen
Telefon: 0551 39-33801
E-Mail: heike.krebber@biologie.uni-goettingen.de
www.uni-goettingen.de/de/192168.html